研究内容
はじめに
生き物はなぜ生きている(生きていられる)のだろう? 誰もが一度は抱いたことのある疑問だと思います。どこをおかしくすると異常が生じるか(病気になるか)、あるいは死んでしまうか、そのような事柄をたくさん調べてまとめ上げれば1つの答えになるのかもしれません。私たちヒトのような多細胞生物の場合には、器官、組織等、色々なレベルで個体の生死を決める要因があるでしょう。一方、バクテリアや菌類の一部には1つの細胞を生命の単位としているもの(単細胞生物)が存在します。また、多細胞生物の場合でも1つ1つの細胞がきちんと機能しない限りは個体としての生命を維持することは不可能です。こう考えると、最初の問いに対する基本的な答えは細胞レベルでの研究の中に見いだすことができるように思えます。
細胞は自身が生き続けるために、増殖するために、あるいは周囲の細胞や組織、そして個体を支えるために、常に無数の現象や反応を引き起こしています。また、細胞内外の様々な変化を察知して、実に見事に対処します。私たちの目では見えないくらい小さな細胞ですが、”細胞目線”で見ると驚くほどダイナミックな現象が見えてきます。すると、細胞はどうしてこんなことができるのだろう?という疑問が湧きあがり、研究の対象は、タンパク質、核酸、脂質(膜)、糖など、細胞を構成する成分(分子)に向かいます。細胞内での現象(細胞の機能)は、おおよそ、これら”パーツ”が特定の組み合わせで規則正しく働くことで起こるからです。そのパーツや規則について調べていくと、(うまくいけば)時計を分解してその動く仕組みを理解するかのように、その現象が起こる仕組みを理解することができます。時計とは異なり、生命現象はヒトが作ったモノではありません。何万年、何億年とかけて、進化の過程で多くの偶然が積み重なって自然にでき上がったものです。それが、ヒトが作ったモノかのような、あるいはヒトでも到底不可能なくらい、巧妙、精緻、秀麗なものであると知ったとき、私たちは大きな衝撃を受け、何とも言えない感動に包まれます。この謎解きはとてもエキサイティングな作業です。
細胞はなぜ生命として存在し得ているのだろう? 細胞はなぜこんなことができるのだろう? その仕組み(メカニズム)を解き明かしたい! このような純粋な”好奇心”が私たちの研究の大きな駆動力となっています。 以下で紹介する”オートファジー”は、何をどうすればこんなことが起こるのか!?と思わずにはいられない実に不可思議でダイナミックな現象です。シグナル伝達、生体膜形成/融合、細胞内輸送、オルガネラ動態、タンパク質分解、遺伝子発現制御など、多くの細胞内現象のエッセンスを包含しており、飢餓応答、代謝制御、細胞内浄化、発生・分化など、細胞の様々な生理機能に重要で、神経変性疾患や肝疾患、細菌感染、ガンといった病気の発症とも深い関係があり、そして何より、その仕組みは未だ多くの謎に包まれている、私たちのような研究者にとって最高の研究対象です。
私たちの研究対象:オートファジー
細胞が営む多くの生命現象は、必要な成分の合成だけでなく、”分解”という過程にも大きく依存しています。生命現象をコントロールするには、必要なものを作るばかりでは駄目で、不要になったものを壊すことも必要です。また、細胞の中に有害な物が生じたらそれらを除去することももちろん重要です。さらに、細胞の構成成分を常に壊しては新しいものと入れ替えることでそれらを新しく保つことも、あまり分裂をしないような細胞では特に重要になってきます。オートファジーは、こうした細胞の基本的な機能維持に関わる細胞内の大規模な分解システムです。
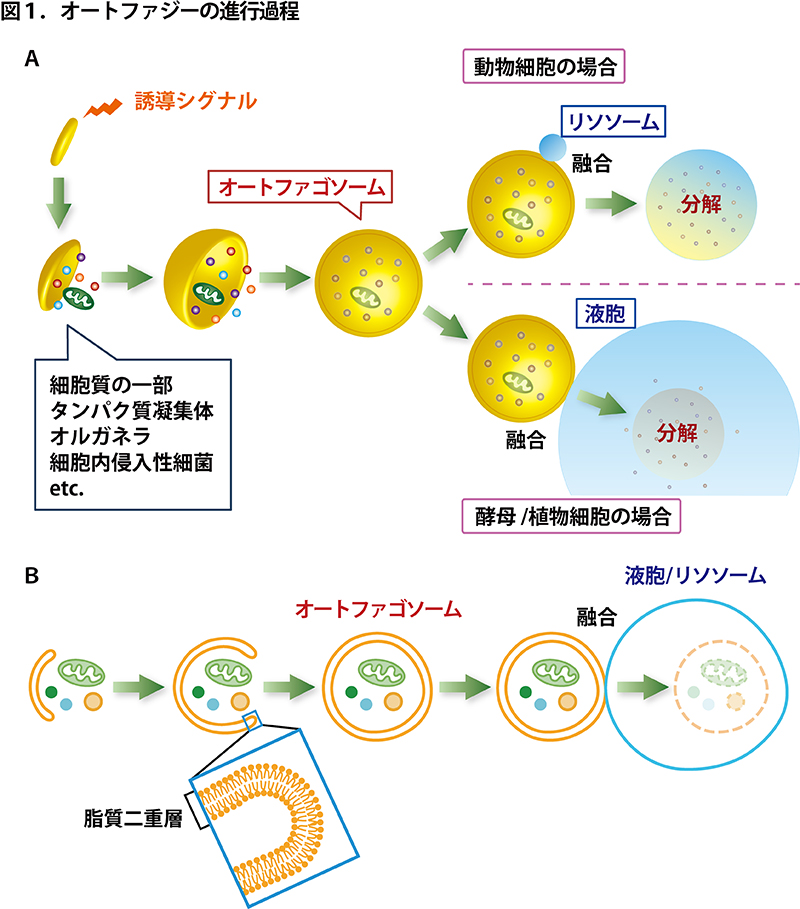
オートファジーは、ギリシャ語で「auto=自分、phagy=食べる」という意味で、”自食作用”とも訳されます。細胞はどうやって自分で自分(の一部)を食べるのでしょう? オートファジーを誘導するシグナルが細胞に入ると、細胞の中に脂質の膜でできた扁平な構造体(中が空のゴムボールをベシャッと押し潰したようなイメージ)が作られ、これが分解対象を包み込むようにして大きく伸展し、球状になって閉じ、「オートファゴソーム」と呼ばれる二重膜胞が形成されます(図1)。図1Aでは立体的な絵を描きましたが、図1Bのような断面で見ると、中空の一枚膜のシートが伸びていって球状になって先が閉じると二枚の膜で仕切られた球状体ができあがる様子を理解しやすいと思います。続いて、オートファゴソームの外側の膜が、色々な種類の分解酵素を含むリソソーム(動物細胞の場合)や液胞(酵母や植物細胞の場合)といったオルガネラ(細胞内器官)の膜と融合することで、オートファゴソームの内側の膜ごとオートファゴソームに取り込まれたものの分解が達成されます。オートファゴソームは、タンパク質やリボソームのような細胞質成分からミトコンドリアのような大きな構造体まで、さらには細胞の中に侵入してきたバクテリア(細胞丸ごと1個)でさえも包み込んでリソソーム/液胞に運び入れます。したがって、大小問わず、タンパク質、核酸、脂質、糖鎖等、あらゆる生体高分子がオートファジーによる分解の対象となりえます。すごいシステムだと思いませんか?
オートファジーという現象は、1960 年代には哺乳類細胞の電子顕微鏡観察により見いだされていましたが、その生理的役割やメカニズム等、長らく研究は進展しませんでした。オートファジーに必要な遺伝子が発見されなかったためです。(遺伝子が見つかれば、その産物のタンパク質の機能を調べたりすることでオートファジーが起こる仕組みを理解することができますし、その遺伝子を破壊してオートファジーが起こらなくなると生物にどのような異常が生じるかを調べることで、オートファジーが果たす役割がわかってくるからです。)1990 年代に入り、本学科学技術創成研究院の大隅良典教授のグループ(東京大学、基礎生物学研究所を経て 2009 年より本学)が、出芽酵母でもオートファジーが起こることを発見しました。出芽酵母は私たちヒトと同じ真核生物の仲間で、遺伝学的解析のしやすさから、様々な基本的生命現象の研究に古くから用いられてきた優れたモデル生物です。大隅先生のグループは、オートファジーを起こせない出芽酵母変異体の取得、原因遺伝子の特定と一挙に進み、多くのオートファジー関連遺伝子(ATG 遺伝子)を同定することに成功しました。これによりオートファジーの研究は一気に加速します。配列検索からヒトを含む哺乳類や高等植物など他の真核生物にも ATG 遺伝子が見つかり、そのノックアウト細胞/個体の解析から、上で触れたような様々な生理機能や病気とオートファジーとの関係が明らかになってきました。今日、オートファジーは生命科学・医学研究の一大潮流とも言える分野にまで発展しており、このような功績がたたえられ、2016年、大隅先生はノーベル生理学・医学賞を受賞されました。

photo by Kabeya Y.
オートファジー(膜新生)が起こるメカニズムを明らかにしたい
2002 年に学位を取得し、そろそろ次の研究室を探そうと思い始めた私(中戸川)は、日本生化学会のシンポジウムで大隅先生の講演を初めて聴く機会を得ました。酵母でのオートファジーの発見、ATG 遺伝子の同定に始まり、その産物である 15 の Atg タンパク質に関する最新の解析結果が示されました。オートファゴソームの形成に関わる遺伝子/タンパク質群を世界に先駆け一挙に同定されたことにも圧倒されましたが、最初からは到底予測不可能な Atg タンパク質たちの驚くべき機能や挙動に興奮し、夢中で聴き入りました。細胞の中に小さな膜が突如として現れ、ギューッと伸びてパクッと閉じる。このとてもダイナミックで不思議な現象の仕組みを自分の手で解いてみたい!と思い、2004 年、博士研究員として当時基礎生物学研究所の大隅研究室のドアをたたきました。基礎生物学研究所で 5 年、本学フロンティア研究機構で 5 年、大隅先生の下で研究させていただき、2014 年 6 月、本学生命理工学研究科 生体システム専攻 形態形成学分野(岩崎博史教授)の准教授に着任し、引き続きオートファジーの研究を続けさせていただいています。この 10 年、私たちを含めて国内外の多くのグループが研究を進め、新しくわかってきたこともたくさんありますが、オートファゴソーム形成機構の謎は未だ解けたと言える段階には至っていません(図2)。
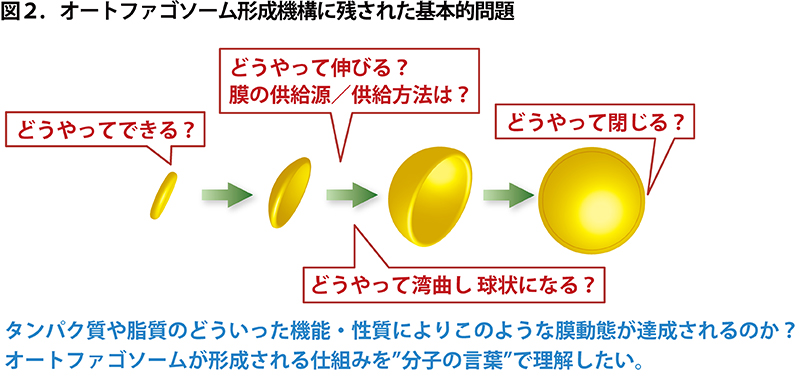
◆ オートファゴソームの”膜の種”はどのようにして作られるのか?
◆ 膜はその”種”からどのようにして伸びていくのか?
◆ 膜を伸ばすための材料(膜/脂質)は細胞の中のどこから調達されるのか?
◆ 膜はどのようにして湾曲して球状になるのか?
◆ 球状になった膜はどのようにして閉じるのか?
こうした極々基本的な疑問に対する答えを私たちは未だに持っていないのです。オートファゴソーム形成機構の解明は手強いですが、まだ多くの魅力的な”宝”が残るやりがいのある課題です。私たちは”分子の言葉”でこれらの問いに答えるべく、研究に励んでいます。
オートファジーにおける標的認識のメカニズム
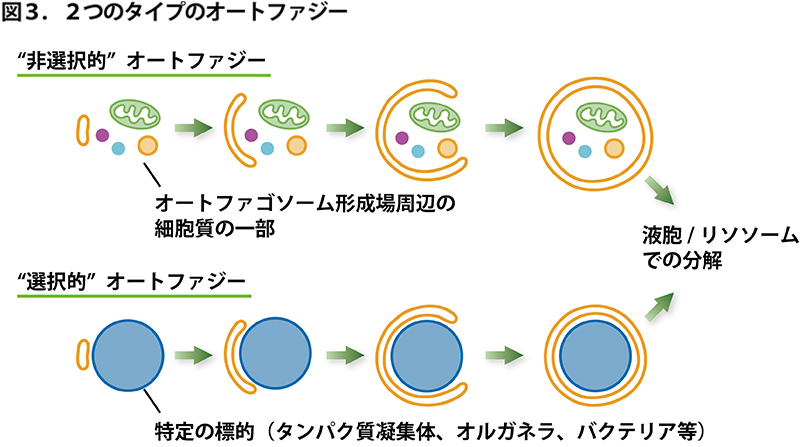
オートファジーは、従来、細胞質の一部を適当に取り込んだようなオートファゴソームがよく観察されたことから、”非選択的”な分解系と考えられていました。(細胞質中でオートファゴソームを作っていけば自然とそこに存在している細胞質が入ってしまうというイメージ。)非選択的なオートファジーは、栄養飢餓条件で強く誘導されます。これは、栄養が足りないときには何でも良いからとにかくたくさん分壊して、分解産物を飢餓時に必要な成分の合成にリサイクルしよう、という細胞の戦略と考えられます。しかし近年、オートファジーには、オートファゴソームが特定の分解標的(神経変性疾患に関連するタンパク質の凝集体、損傷したミトコンドリア、不要になったペルオキシソーム、細胞内に侵入したバクテリア等)に狙いを定めて包み込む、”選択的”なモードもあることがわかってきました(図3)。選択的なオートファジーは、その疾患等との直接的な関係からも盛んに研究が進められています。
オートファゴソームの膜がどのようにして作られるのか、という問題は、非選択的、選択的、両方のタイプのオートファジーにおおよそ共通の問題になりますが、選択的オートファジーに特有の問題として、
◆ どうすれば特定のものをオートファゴソームに”狙って食べさせる”ことができるのか?
という問題があります。また、選択的オートファジーにおいても、標的の分解は、分解すべきときだけ分解すべく、厳密に制御される必要があります。
◆ 選択的オートファジーにおける標的認識はどのように制御されているのか?
という問題を明らかにすることも重要です。私たちが知らない選択的オートファジーの標的がまだまだ眠っている可能性もあります。私たちは、これら選択的オートファジーに関する課題にも取り組んでいます。
以上のように、私たちの直接の研究目的は「オートファジーを支える分子機構の解明」ということになりますが、この目的を達成する過程で、オートファジーのメカニズムの理解に留まらず、細胞内でのタンパク質や脂質膜の基本的な性質やふるまい等、様々な生命現象を理解する上で重要となる普遍的な原理の提出にもつながるような成果を発信していきたいと考えています。
研究手法について
生命現象を支える基本的なメカニズムは生物種を問わず普遍的であり、その解明にはシンプルなモデル生物を用いるに限る、という信念の下、私たちは出芽酵母を用いてオートファジーの分子機構の研究に取り組んでいます。(その普遍性を自分たちの手で実証するために将来的には動物培養細胞を用いた実験系の導入も考えていますが。)酵母には、他の高等真核生物と比べて、生育が早い、培養が安価におこなえる、遺伝子や細胞内の構造がシンプルである、変異株の分離/構築が容易である等、実験上の利点が数多くあります。また、その長い研究の歴史から膨大な情報の蓄積があります。これにより、クリアな論理に基づいて厳密にかつ迅速に研究を展開することができます。仮説の提唱 → 実験のデザイン → 材料の準備(変異細胞の構築など)→ 実験 → 結果の解釈・考察 → 次の実験のデザイン/新たな仮説の提唱 → 、、、というようなサイクルをどんどんまわすこともできます。大学院生のような研究の初心者が研究に必要な基本的な能力を養うには、また、研究の面白さを実感するにはとても良い実験系だと思います。また、私たちは、細胞生物学的手法、分子生物学的手法、生化学的手法、様々な手法を駆使して謎の解明に挑んでいます。タンパク質の結晶構造解析を得意とする微生物化学研究所の野田展生先生のグループとの共同研究により、構造生物学的なアプローチもおこなっています。酵母の実験系で培われた力は、必ずや他の生物や他の生命現象の研究にも役立つに違いありません。以下に、私たちの研究手法をいくつか紹介します。
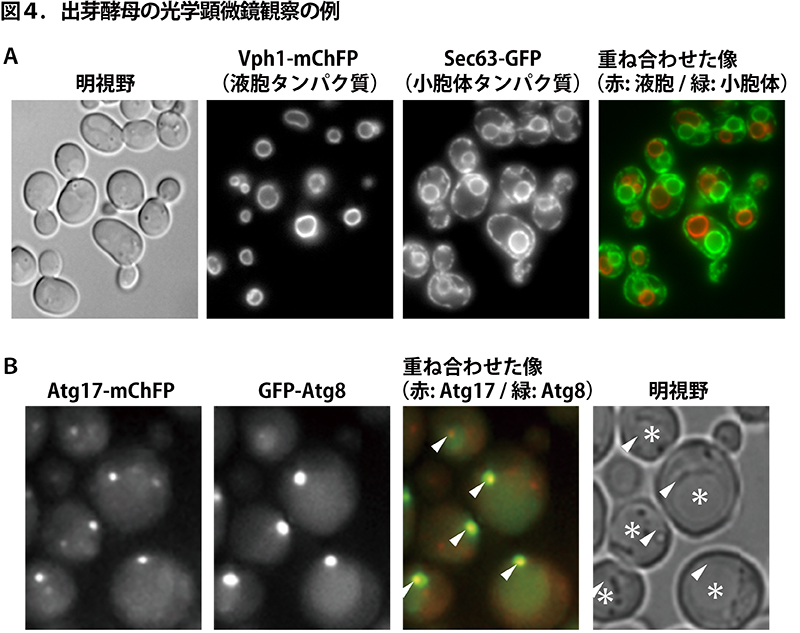
<蛍光顕微鏡解析> まず、光学(蛍光)顕微鏡観察の例です(図4)。図4Aの「明視野」に示すように、出芽酵母は長径 5 マイクロメートル程の卵のような可愛らしい形をしています。その名の通り、母細胞が芽(娘細胞)を出して増えていきます。液胞膜にいる Vph1 というタンパク質に赤色蛍光タンパク質 mChFP を付加して蛍光像を得ると、左から2番目のような感じで液胞が観察されます(本当は歪んだ球状ですが焦点があったところで断面(リング)のように見えます)。酵母の液胞は明視野でも少し明るい部分として見えます。左から3番目は、小胞体膜にいる Sec63 というタンパク質に緑色蛍光タンパク質 GFP を付加すると得られる蛍光像です。出芽酵母の小胞体は、細胞膜の直下(明視野の細胞の形と同じように見えている部分)と核の周囲(丸く見えている部分)に主に観察されます。これら3つの像は同時に撮影したものです。液胞の像(赤)と小胞体の像(緑)を重ね合わせると、一番右の像の様になります。細胞の中のかなりの部分が核と液胞で占められていることがわかります。
図4Bは、Aと同様に、Atg17 と Atg8 というオートファゴソームの形成に関わるタンパク質(Atgタンパク質)に異なる蛍光タンパク質を付加した細胞をオートファジーを誘導してから観察したものです。2つのタンパク質が液胞(明視野像内, *)の近くで一所に集まっている様子が見られます(重ね合わせた像では白い矢頭で示しました)。ここでまさにオートファゴソームの形成が起きているのです。このようにして、オートファゴソームの形成に関わるタンパク質の細胞内での動きや他の細胞内器官との関係などを調べます。
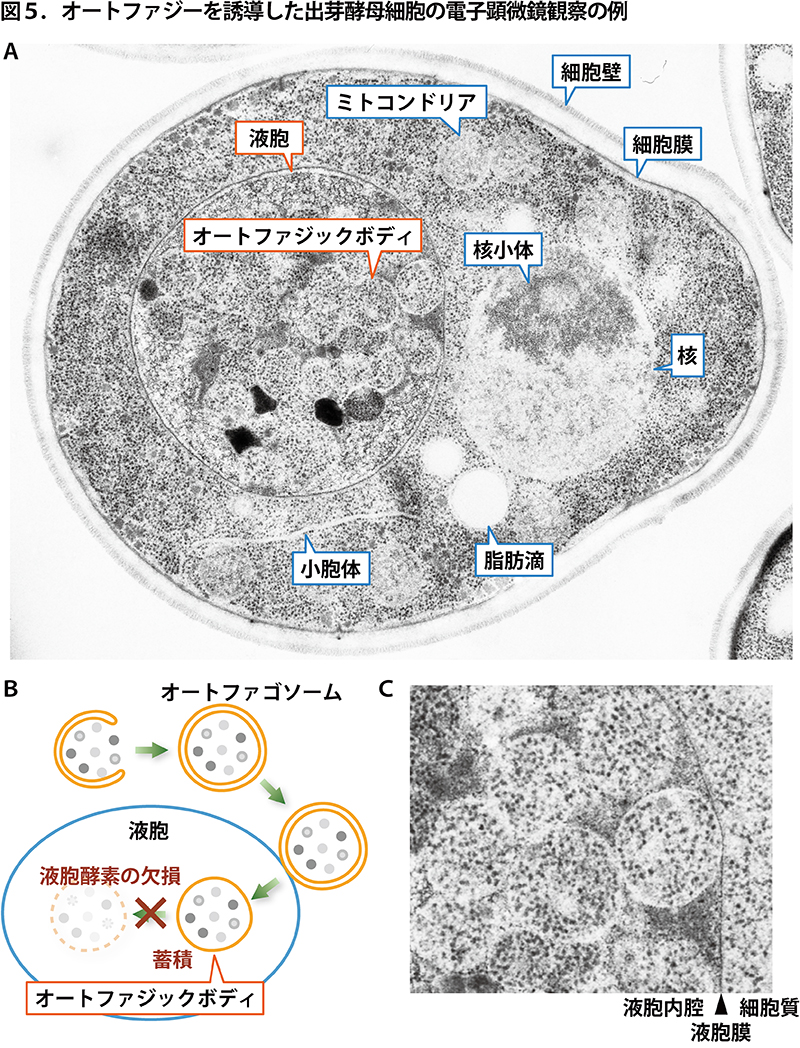
<電子顕微鏡解析> 次は、電子顕微鏡観察の例です(図5)。電子顕微鏡では、光学顕微鏡よりも高解像度で細胞内の微細構造を観察することができます。出芽酵母の切片を透過型電子顕微鏡で観察すると、図5Aのような像が得られます。核、液胞、ミトコンドリア、小胞体など、様々な細胞内器官が断面図として見えています。それぞれの特徴が表れていて、見ているだけでとても楽しいです。図5Bに示すように、 通常、オートファゴソームの外膜が液胞と融合すると、内膜で囲まれた構造体(オートファジックボディ)はすぐに液胞の中で分解されてしまうのですが、液胞内の分解酵素を欠損させた変異株を用いることで、オートファジックボディを液胞内に溜め込ませて観察することができます。図5Aでもそのような細胞を用いているので、液胞の中にオートファジックボディがぎっちり詰まっている様子が観察されます。
図5CにはAの写真の一部を拡大して載せました。液胞内(液胞膜(矢頭で示したところを縦に走る黒い線)の左側)にオートファジックボディが多数見えており、その中には細胞質(液胞膜の右側)がそのまま封じ込められている様子が見て取れます。(無数の黒い点はリボソームです。)このように、電子顕微鏡解析をおこなうことで、細胞内器官やオートファゴソーム、オートファジックボディの様子をより明確に詳細に観察することができます。

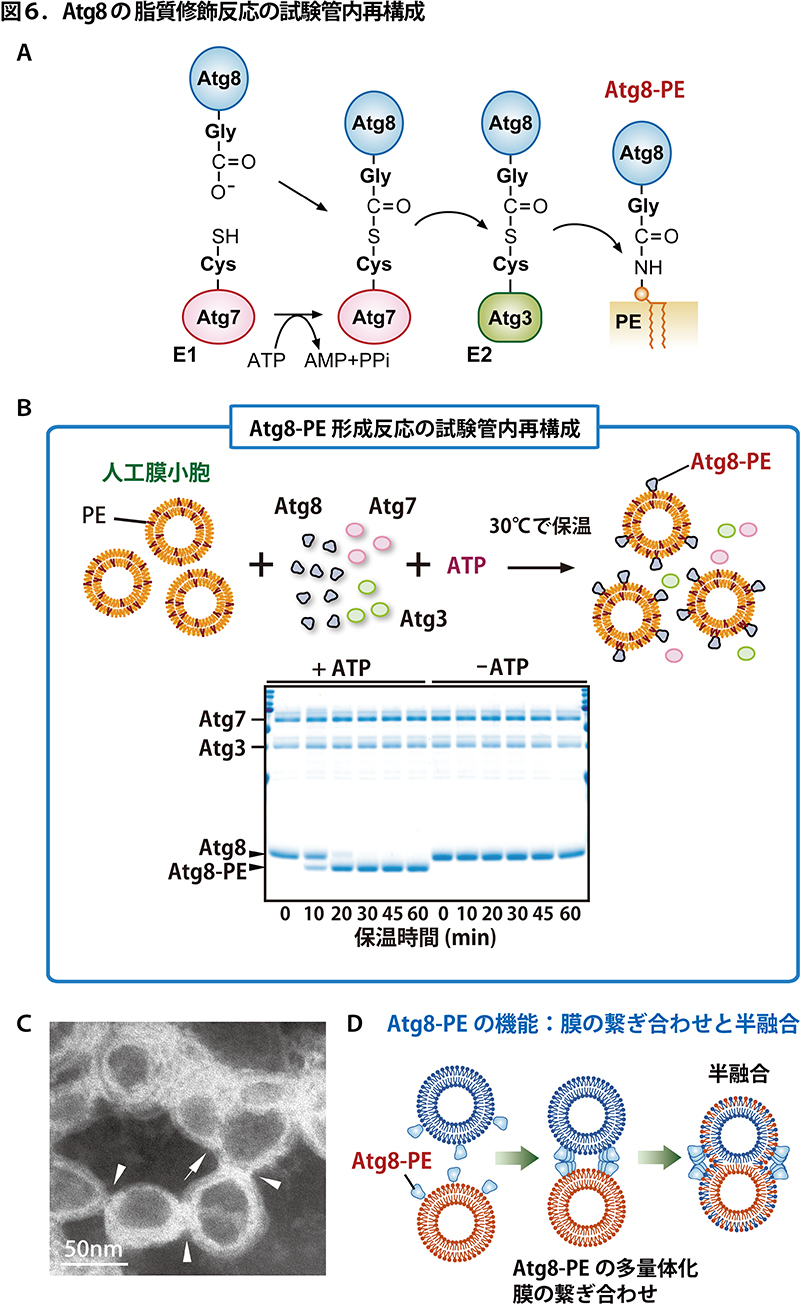
<試験管内再構成> あるタンパク質にどういった機能があるのか知りたいとき、細胞の中にはたくさんの種類のタンパク質やその他の分子が混在しているため、そのままでははっきりとした結論が得られないことがあります。また、ある生命反応や現象のメカニズムを詳細に解析するためには、共存する成分を限定したり、実験条件をより厳密にコントロールする必要が出てきます。そのような場合には、関連するタンパク質等の成分をきれいに単離し、試験管の中で混ぜ合わせ、その反応や現象を試験管の中で再現するといったアプローチをとります。図6には、オートファゴソーム形成に重要な Atg8 というタンパク質の脂質化反応の再構成を例として示しました。Atg8はユビキチンに似た小さなタンパク質で、ユビキチン結合反応と同様に E1 酵素(Atg7)、E2 酵素(Atg3)が触媒する反応を経て、脂質分子であるホスファチジルエタノールアミン(PE)に結合します(図6A)。ユビキチンや他のユビキチンに似たタンパク質は全て、別のタンパク質のリジン残基に結合するので、結合の相手が脂質である点でこの反応はとてもユニークな反応です。一村義信博士(現 東京都医学総合研究所)は、Atg8, Atg7, Atg3、これら 3 つの出芽酵母のタンパク質を別々に大腸菌に作らせ(特定のタンパク質を大量に作らせることができ、また他の酵母のタンパク質が混入することがない)、精製し、PE を含む人工膜小胞と ATP と混ぜ合わせることで、Atg8 と PE との結合反応を試験管の中で再現することに成功しました(図6B; 反応液中のタンパク質を SDS-PAGE で分離したのち CBB で青色に染色したもの。ATPがあるときだけ(+ATP)、時間経過と共に Atg8 のバンドが Atg8-PE のバンドに変換されていっています)。これにより、Atg8, Atg7, Atg3, PE, ATP がこの結合反応の必要最小限の成分であることがわかります。
この再構成系では、図6B右上の絵のような感じで人工膜小胞上の PE に Atg8 が結合します。反応後の溶液を電子顕微鏡で解析した結果、図6Cに示すように人工膜小胞(白いリング状に見えているもの)同士が結合しあったり(矢頭で示した箇所)、半融合(矢印で示した箇所;図6Dの絵も参照)したりしている様子が観察されました。 さらにその他の生化学的解析結果と合わせて、図6Dに示すように、Atg8 には PE と結合すると多量体化して(互いに結合し合って)、自身がアンカーされた膜同士を繋ぎ合わせ、半融合させる機能があることが明らかとなりました。試験管内再構成系でなければ、このような Atg8-PE の機能は見えてこなかったでしょう。試験管内で膜の繋ぎ合わせ・半融合ができない Atg8 の変異体は、オートファゴソームの形成に異常を示すことも明らかになりました。このようにして、試験管内再構成系での解析結果を細胞内でのイベントと関連づけることができます。
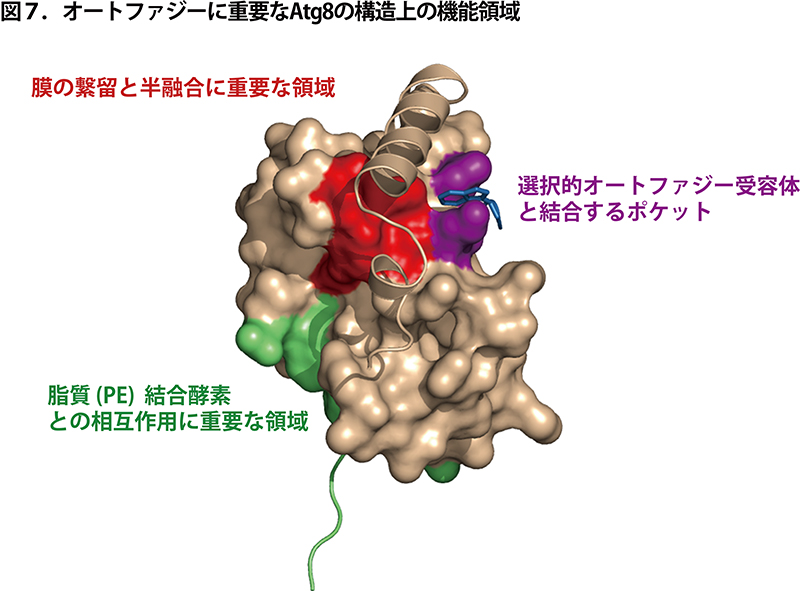
<構造生物学的解析との融合> 図7は、北海道大学の稲垣冬彦先生・微生物化学研究所の野田展生先生のグループが決定した Atg8 の原子レベルでの立体構造です(図は野田先生にいただきました)。Atg8 は分子量 約14,000 の小さなタンパク質ですが、複数の機能を有しています。それぞれの機能に異常を示す変異体の変異部位(アミノ酸残基)を構造上にマッピングすると、緑、赤、紫に色分けしたように、Atg8 は分子表面を巧みに使い分けて様々な機能を発揮していることがわかります。
<一般的な分子生物学的・生化学的解析> 私たちはもちろん、ウエスタンブロッティングや免疫沈降解析、酵素活性測定など、一般的な分子生物学的・生化学的解析も日常的におこないます。これらの解析では”目(顕微鏡)では見えない”事象を取り扱うことが多く、結果も数値であったり単なるゲル上のタンパク質や核酸のバンドとして得られることが多いですが、様々な条件で得られた結果を総合的に解釈したり、変異解析や構造情報と組み合わせたりすることで、生体分子の働くさまをまるで見てきたかのように想像する(他人にも想像させる)ことができます。百聞は一見にしかず、の顕微鏡解析とはまた違う研究の醍醐味を味わうことができます。
以上のように、私たちは様々な解析手法を組み合わせ、細胞、細胞内器官、分子集合体(脂質膜、タンパク質複合体)、分子、原子、様々な階層で総合的にオートファジーを支えるメカニズムの解明を進めています。さらに具体的な研究内容やこれまでの研究成果については、原著論文、総説をご覧下さい。